- Parameterauswahl
- Patientenvorbereitung
- Probenentnahme
- Probenverarbeitung
- Transport
- Registrierung
- Materialprüfung
- Lagerung
- Verteilung
- Probenvorbereitung
- Durchführung der Analyse
- Technische Validierung
- Medizinische Validierung
Vor Abnahme des Blutes muss unbedingt geklärt sein
Welcher Parameter soll untersucht werden?
Welche Materialien benötigt das Labor?
Wie muss das Probenmaterial entnommen werden?
Welche Gefäße verwendet man zum Einsenden der benötigten Materialien?
Welche Einflussgrößen müssen bei der Entnahme des Materials beachtet bzw. festgehalten werden?
Wie muss das entnommene Material weiterbehandelt werden?
Wie muss das Probenmaterial bis zur Abholung gelagert werden?
Wie muss das Probenmaterial für den Transport verpackt werden?
Wie muss der Überweisungsschein ausgefüllt werden und welche Angaben müssen auf den Schein?
Was muss man bei der Abholung beachten?
Demgegenüber sind Einflussgrößen Faktoren, die im Patienten zu einer Veränderung der Messgröße führen.
Das heißt: das Labor ermittelt ein technisch richtiges Messergebnis, das jedoch nur im Kontext der Einflussgröße korrekt interpretiert werden kann.
- Nahrungs- und Flüssigkeitsaufnahme
- Tagesrhythmik von Parametern
- Körperlage
- Medikamenteneinnahme und medizinische Maßnahmen
Der Patient sollte nüchtern sein. Als "nüchtern" gilt nach Empfehlungen der Deutschen Diabetes Gesellschaft ein Patient, der mindestens 8 Stunden gefastet hat. Es liegt jedoch auf der Hand, dass die Empfehlungen weder unter praktischen (nicht alle Patienten können morgens zur Blutentnahme erscheinen) noch unter medizinischen Gesichtspunkten (z. B. Kleinkinder, Hypoglykämie-gefährdete Diabetiker) in allen Fällen umsetzbar ist.
Deshalb sollten die folgenden Regeln beachtet werden:
Blutentnahme nur am nüchternen Patienten für folgende Parameter:
- Glucose
- Insulin
- C-Peptid
- Parameter des Fettstoffwechsels
- Funktionsteste, bei denen ein Glucose-Anstieg bzw. -Abfall relevant ist (oGTT, Insulin, Hypoglykämietest)
- gastrointestinale Funktionsteste
Bei den meisten anderen Parametern kann die Blutentnahme auch am nicht nüchternen Patienten erfolgen; d. h. eine leichte Nahrungsaufnahme kann gestattet werden. Hierbei sollte ein Exzess an Fetten und Kohlenhydraten in jedem Fall vermieden werden.
Für einzelne Messgrößen müssen bestimmte diätetische Einschränkungen, die Sie unserem Leistungsverzeichnis entnehmen können, beachtet werden.
Hiervon betroffen sind z. B. die Anlayte Hydroxyindolessigsäure, Katecholamine und dessen Metabolite.
Bestimmte Parameter (vor allem Hormone, siehe Tabelle) zeigen eine ausgeprägte Tagesrhythmik. Daher muss in Abhängigkeit von der Fragestellung der Abnahmezeitpunkt richtig gewählt werden.
Dies betrifft in der Praxis am häufigsten die Achse Hypophyse - Nebennierenrinde und damit die Parameter Cortisol und ACTH.
| Analyt |
Uhrzeit Maxiumum |
Uhrzeit Minimum |
Amplitude (% Tagesmittelwert |
| ACTH | 6 - 10 | 0 - 4 | 150 - 200 |
| Cortisol | 5 - 8 | 21 - 3 | 180 - 200 |
| Aldosteron | 2 - 4 | 12 - 14 | 60 - 80 |
| TSH | 20 - 2 | 7 - 13 | 20 - 30 |
| Eisen | 14 - 18 | 2 - 4 | 50 - 70 |
Beim Lagenwechsel eines Patienten kommt es zu einer Wasserverschiebung im Körper. Konzentrationen von Blutbestandteilen sind daher abhängig von der Körperlage. Deshalb muss vor einer Blutentnahme (z. B. nach längerem Stehen) die Äquilibrierung der Körperlage abgewartet werden.
Einige Parameter (z. B. Aldosteron, Adrenalin, Noradrenalin und Renin) werden durch Blutdruck und Herzfrequenz, die ihrerseits von der Körperlage abhängig sind, beeinflusst. Deshalb ist es zur Bestimmung von Ruhespiegeln besonders wichtig, den Patienten ausreichend lang an die Ruhelage adaptieren zu lassen.
Das gleiche Phänomen beobachtet man bei zu langem Stauen der Vene (länger als 30 sec.). Auch hier fließen das Wasser und die niedermolekularen Blutbestandteile ins Interstitium ab. Blutzellen, Makromoleküle und proteingebundene Substanzen können die Membran nicht passieren und reichern sich im Intravasalraum an.
Nicht steuerbare Einflussgrößen sind gegebene biologische Eigenschaften des Patienten, die nicht von der Patientenvorbereitung abhängen.
Sofern Sie Kenntnis von solchen Faktoren haben, sollten Sie das dem Labor mitteilen, um die Befundinterpretation im richtigen Kontext zu gewährleisten.
Zu diesen Einflussgrößen zählen u. a.:
- Geschlecht
- Zyklus bei Frauen
- Schwangerschaft
- Grunderkrankung
- Ethnische Herkunft
Der Einfluss von Alter und Geschlecht auf viele Laborparameter ist hinlänglich bekannt und wird vom Labor durch die Verwendung alters- und geschlechtsspezifischer Referenzbereiche berücksichtigt. Der hormonelle Zyklus der Frau beeinflusst den Spiegel der Geschlechtshormone, deshalb sollten Informationen über den Zyklustag, Zyklusanomalien oder eine bereits eingetretene Menopause mitgeteilt werden.
Schwere Grunderkrankungen, eine Schwangerschaft oder auch die ethnische Herkunft eines Patienten können im Einzelfall eine differenziertere Interpretation des Laborbefundes erforderlich machen. Hierzu empfehlen wird ggf. unsere Fachärzte zu konsultieren.
Andere häufige Störungen sind durch Medikamente oder immunologische Phänomene bei bestimmten Grunderkrankungen (EBV-Infektion, Gammopathien, Autoimmunerkrankungen) bedingt.
Einen Teil der relevanten Störgrößen können Sie durch präanalytische Maßnahmen (nüchterner Patient!), eine korrekte Blutentnahmetechnik sowie durch geeignete Bedingungen der Probenverarbeitung und des Probentransports verhindern.
Es gibt keine Möglichkeit Störgrößen zu beeinflussen, die ein Merkmal der Krankheit des Patienten sind (z.B. die intravasale Hämolyse bei autoimmunhämolytischer Anämie oder die Lipämie bei einer schweren Fettstoffwechselstörung).
Viele kommerzielle Immunoassays nutzen technologisch die Bindung biotinylierter Antikörper und Proteine an Streptavidin-beschichtete Oberflächen oder Substrate. Theoretisch besteht bei diesen Testen die Möglichkeit einer Interferenz mit Biotin, wenn es in sehr hoher Konzentration in der Patientenprobe vorliegt. Ergänzungspräparate, die hohe Dosen Biotin (Vitamin H) enthalten, können rezeptfrei in der Apotheke erworben werden, zudem wird Biotin auch therapeutisch eingesetzt. In der jüngeren Vergangenheit wurden einige Fälle publik, bei denen durch Biotin-Interferenz verursachte falsche Laborergebnisse zu klinisch relevanten Folgen für den Patienten geführt haben. Potentiell betroffen sind alle Immunoassays, bei denen in einem Arbeitsschritt Streptavidin-beschichtete Mikropartikel zusammen mit Biotin-enthaltendem Serum oder Plasma inkubiert werden. Dazu zählen in unserem Labor die elektrochemischen Lumineszenzimmunoassays (ECLIA) der Fa. Roche Diagnostics sowie auf ähnlichen Detektionsprinzipien beruhende Teste der Fa. Siemens. Bei vielen Testverfahren wurden in den letzten Jahren Verbesserungen vorgenommen, so dass die Biotininterferenz nur noch bei wenigen Analyten eine Rolle spielt.
Potentiell von einer Biotininterferenz betroffene Testverfahren, Biotinkonzentration, bis zu der eine Interferenz durch den Hersteller ausgeschlossen wurde und mögliche Veränderung der Testergebnisse durch Biotininterferenz
Biotininterferenz (Stand: 01/2025)
| Parameter | Biotingrenzwert (ng/ml) | Möglicher Einfluss auf Wertelage |
|---|---|---|
| Anti-TPO | 10 | höher |
| Anti-TSRE | 600 | höher |
| Beta-HCG | 70 | niedriger |
| CA 125 | 70 | niedriger |
| CA 15-3 | 70 | niedriger |
| CA 19-9 | 100 | niedriger |
| CCP-Ak | 70 | niedriger |
| CEA | 70 | niedriger |
| Cortisol | 30 | höher |
| C-Peptid | 60 | niedriger |
| Cylosporin | 30 | höher |
| CYFRA 21-1 | 50 | niedriger |
| DHEA-Sulfat | 70 | höher |
| Digitoxin | 70 | höher |
| Digoxin | 100 | höher |
| Erythropoetin1) | 2 | niedriger |
| Folsäure | 21 | höher |
| Folsäure im Erythrozyten | 21 | höher |
| HE4 | 120 | niedriger |
| Holotranscobalamin | 40 | höher |
| IgE gesamt | 100 | niedriger |
| Insulin | 60 | niedriger |
| LH | 50 | niedriger |
| NSE | 70 | niedriger |
| Östradiol | 36 | höher |
| Parathormon intakt | 50 | niedriger |
| PINP (Prokollagen INP) | 50 | niedriger |
| PLGF | 30 | niedriger |
| Progesterone | 30 | höher |
| Prolaktin | 40 | niedriger |
| sFLT-1 | 30 | niedriger |
| SHBG | 70 | niedriger |
| Vitamin B12 | 50 | höher |
| Hepatitis | ||
| Anti-HAV | 140 | höher / falsch positiv |
| Anti-HAV IgM | 50 | falsch negativ |
| HBe-Ag | 40 | falsch negativ |
| Anti-HBc IgM | 100 | falsch negativ |
| Anti-HBe | 100 | falsch positiv |
Angaben zu den Biotingrenzwerten auf der Basis der Angaben von Roche Diagnostics (ECLIA) bzw. 1) Siemens Healthineers. Möglicher Einfluss auf die Wertelage auf der Basis des Testprinzips: kompetitive Immunoassays: Abnahme des Messsignals führt zu erhöhten bzw. falsch positiven Messergebnissen; Sandwichprinzip: Abnahme des Messsignals führt zu erniedrigten bzw. falsch negativen Resultaten.

20 - 45 min stehend lagern
(„gerinnen lassen“)
10 min bei 2000 g zentrifugieren
(EDTA, Heparin, Citrat)
sofort
10 - 20 min bei 2000 g zentrifugieren
Serum
Plasma
Durch Verschleppungen und Kontamination von Zusätzen können sonst lebensbedrohliche Messfehler entstehen!














Für die Messung der Blutsenkung wird Citratblut in der Verdünnung 1+5 verwendet. Die spezielle Form der Abnahmeröhrchen (z. B. Sedivette® oder Vacuette®) erlauben, diese direkt in Ablesevorrichtungen einzuspannen, um die Werte anhand eines Messlineals ablesen zu können.
Bei Citratblut-Proben ist die Präanalytik besonders wichtig. Bitte beachten Sie daher:
Citratblut-Röhrchen müssen komplett bis zur Markierung befüllt werden! Bei falsch befüllten Röhrchen (Unterfüllung oder Überfüllung) können KEINE validen Ergebnisse ermittelt werden, da das Mischungsverhältnis mit dem flüssigen Antikoagulanz nicht korrekt ist.
Weiteres siehe Entnahmereihenfolge bei der Abnahme mehrerer Röhrchen



Bei Citratblut-Proben ist die Präanalytik besonders wichtig.
Bitte beachten Sie daher:
Citratblut-Röhrchen müssen komplett bis zur Markierung befüllt werden! Bei falsch befüllten Röhrchen (Unterfüllung oder Überfüllung) können KEINE validen Ergebnisse ermittelt werden, da das Mischungsverhältnis mit dem flüssigen Antikoagulanz nicht korrekt ist. Citratröhrchen für Gerinnungsuntersuchungen nie am Anfang abnehmen, da das erste Röhrchen mit Gewebeflüssigkeit (Gewebe-Thromboplastin) kontaminiert sein kann.
Weiteres siehe Entnahmereihenfolge bei der Abnahme mehrerer Röhrchen







- Besprechen Sie die Anforderung vorab mit unserem Labor unter der Telefonnummer 0821 / 4201-900. Hier können Sie auch ein spezielles Abnahmeset für die Thrombozytenfunktion bestellen
- Planen Sie Ihre Abnahmen nur Montag bis Donnerstag, idealerweise kurz bevor unser Laborfahrdienst Ihre Praxis anfährt um die Proben zu holen.
- Die BAPA-Röhrchen müssen analog Citratblut komplett befüllt werden um eine aussagekräftige Analytik zu erreichen. Verwenden Sie zur Abnahme das beiliegende Abnahmeset, achten Sie auf eine kurze Stauung.
- Nach der Abnahme mischen Sie die Röhrchen durch vorsichtiges Schwenken. BAPA-Röhrchen dürfen nicht zentrifugiert oder eingefroren werden!!!
- Lagern Sie die entnommenen Proben bis zur Abholung durch den Fahrdienst bei Raumtemperatur
- Kennzeichnen Sie die Anforderung auf dem Überweisungsschein: „Thrombozytenaggregation“ oder „Thrombozytenfunktion“ und geben Sie (falls vorhanden) entsprechende Medikationen (z. B. Clopidogrel, ASS, Prasugrel) an. Sollten keine Medikamente eingenommen werden, können Sie dies ebenfalls vermerken.
- Sollte keine Blutentnahme erfolgen (z. B. Patient nicht erschienen oder Blutentnahme nicht mehr notwendig), rufen Sie bitte unter der o. g. Telefonnummer an und geben uns für die weiteren Planungen Bescheid.

Der Zusatz von Heparin als schonendstes Antikoagulanz ist nur bei wenigen Parametern erforderlich, bei denen die Leukozyten des Patienten intakt und teilungsfähig bleiben müssen z. B. für den ELISPOT-TB oder für Chromosomenanalysen.



Natriumfluorid blockiert den Zellstoffwechsel im Erythrozyten durch Hemmung der Glykolyse.


Für eine genaue Messung des Blutzuckerspiegels sind Probenröhrchen notwendig, welche verhindern dass die Glukose sich während des Transportes in das Labor abbaut. GlucoExakt-Röhrchen stabilisieren den Glukosewert im Blut bis zu 96h.
GlucoExakt-Röhrchen müssen komplett befüllt werden! Bei falsch befüllten Röhrchen (Unterfüllung oder Überfüllung) können KEINE validen Ergebnisse ermittelt werden, da das Mischungsverhältnis mit dem flüssigen Antikoagulanz nicht korrekt ist. Weiteres siehe Entnahmereihenfolge bei der Abnahme mehrerer Röhrchen
- 50 g Glucose-Suchtest: ein Röhrchen
- oGTT Gestationsdiabetes 75 g: drei Röhrchen






- zu dicker Ausstrich (Bluttropfen zu groß)
- ungleichmäßiges Ausstreichen (führt zu Stufenbildung)
- zu langsames Ausstreichen (Erythrozyten klumpen zusammen)
- Falsche Beklebung

- Zu viel Blut verwendet (Ausstrich ist zu dick)
- Zu wenig Blut verwendet
- Bluttropfen „läuft“ über Objektträger
- Leerer Objektträger ohne Blut wurde eingesandt
- Blut wurde unter Deckglas oder zweitem Objektträger eingeschlossen
- Barcode wurde über die Ausstrichfahne geklebt
- Geplante Blutentnahmen sollten zur Verlaufsbeurteilung und zur Vermeidung von Tagesschwankungen immer zur gleichen Tageszeit erfolgen, im Idealfall zwischen 7:00 und 9:00 Uhr morgens. In Abhängigkeit vom Parameter (Tagesrhythmik!) können auch andere Zeitpunkte sinnvoll sein.
- In der Regel nüchtern; die letzte Nahrungsaufnahme sollte 12 h zurückliegen. Keine Alkoholexzesse und keine erschöpfenden körperlichen Aktivitäten in den vergangenen 3-4 Tagen.
- Der Patient sollte liegen und diese Position 15 min lang beibehalten. Die bevorzugte Entnahmestelle ist eine gut sichtbare periphere Oberflächenvene der Ellenbeuge.
- Besteht der Verdacht, dass ein Medikament die Analyse beeinflusst, sollte geprüft werden, ob das Medikament abgesetzt werden kann.
Die Person, die die Blutabnahme durchführt, muss stets Handschuhe tragen. Lt. TRBA sollten Sie sich mit speziellen Abnahmesystemen vor Nadelstichverletzungen schützen.
Es ist dringend anzuraten, Sicherheitskanülen zu verwenden.
Das bei der Probennahme verwendete Material muss nach der Verwendung fachgerecht entsorgt werden.



- Sicherstellen, dass alle Materialien zur Blutabnahme bereit liegen und vollständig sind (Röhrchen, Halter, Kanüle, Tupfer, Desinfektionsmittel, Handschuhe, Pflaster, Staubinde).
- Geeignete Vene suchen und ca. 10 cm (handbreit) oberhalb der Ellenbeuge stauen.
- Desinfizieren der Punktionsstelle mit geeignetem Hautantiseptikum (z. B. 70% Isopropanol, 70-80% Ethanol).
- Stauen (30-50 mmHg, der Puls muss noch fühlbar sein), ca. 30 sec.
- Mit dem Daumen der freien Hand durch Zug die Haut der Punktionsstelle spannen und die Vene fixieren.
- Mit 1er oder 2er Kanüle in Richtung Vene stechen, Winkel von ca. 30° einhalten, Kanülenspitze unten.
- Patient kurz vor dem Einstich auf Vorgang aufmerksam machen.
- Nicht tiefer einstechen als der Venendurchmesser.
- Mit Kolben nur soviel Unterdruck erzeugen, dass das Blut frei läuft (Kanüle drehen bei Stopp des Blutflusses).
- Entstauen, sobald das Blut fließt. Öffnen und Schließen der Faust vermeiden!
-
Nach Entfernen der Kanüle den Blutfluss sofort stoppen durch Druck mit Tupfer auf Punktionsstelle (2 – 4 min), Arm nach oben halten, nicht beugen (Wundschluss wird gestört).
Kanüle in Sicherheitsbehälter entsorgen.
- Röhrchen mit Antikoagulantien müssen sofort mehrmals invertiert werden (nicht schütteln).
- Blutkulturen
- Nativblut ohne Zusätze
- Citratblut
- Heparinblut
- EDTA-Blut
- Glykolysehemmer (z. B. Fluorid)
Citratröhrchen für Gerinnungsuntersuchungen nie am Anfang abnehmen, da das erste Röhrchen mit Gewebeflüssigkeit (Gewebe-Thromboplastin) kontaminiert sein kann. Röhrchen mit Additiven kommen immer nach dem Nativröhrchen, um Kontaminationen zu vermeiden. Aus diesem Grund muss vor jeder Citratblutentnahme (z. B. Quick-Kontrolle bei Cumarin-Therapie) vorab ein Vollblut/Serum-Röhrchen entnommen werden. Dieses Röhrchen – sollte es nicht anderweitig benötigt werden – muss nicht komplett befüllt werden.

- RZB = relative Zentrifugalbeschleunigung
- rpm = Drehzahl pro Minute (engl. revolutions per minute), U/min
- r = Zentrifugenradius in mm

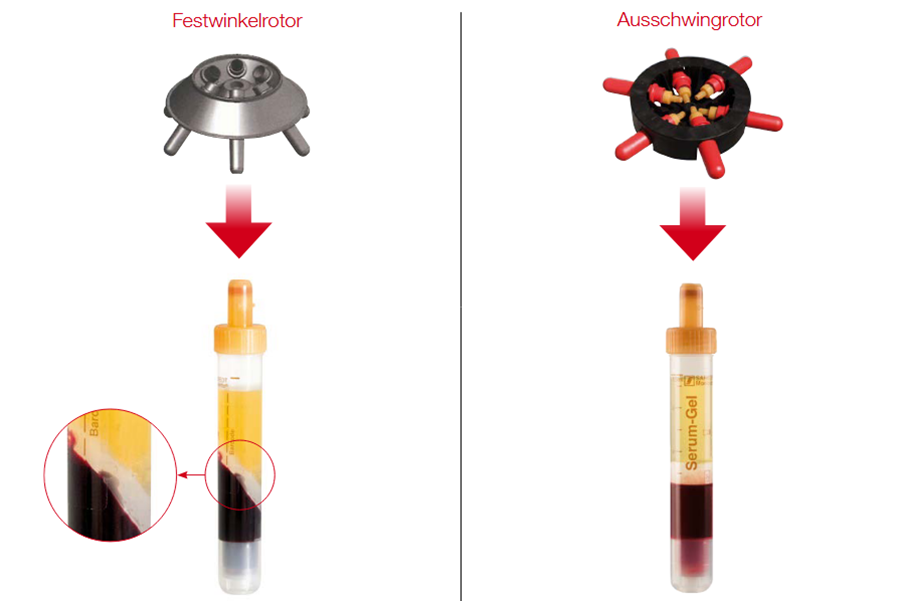
Sollten Sie eine Zentrifuge mit Festwinkelrotor besitzen, bitten wir darum, das Serum in der Praxis in ein neutrales Röhrchen abzukippen und dieses einzusenden.
Niemals Blut einfrieren oder im gefrorenen Behälter versenden! Immer zuerst zentrifugieren, dann abpipettiertes Serum oder Plasma einfrieren, falls nicht ausdrücklich anderes im Leistungsverzeichnis verlangt wird.
- Abgetrenntes Serum oder Plasma (bitte beschriften) für 12-24 h in ein normales 3-Sterne Gefrierfach (-20°C) eines haushaltsüblichen Kühlschranks legen.
- Versandbehälter ohne Styroporhülle ebenfalls für mindestens 12-24 h liegend einfrieren (durch Schütteln prüfen, ob die gesamte Kühlflüssigkeit gefroren ist).
- Serum- oder Plasmaprobe noch nicht in den Versandbehälter einbringen.
- Kurz vor der Abholung getrennt eingefrorenes Untersuchungsmaterial in den vorbereiteten Versandbehälter stecken.
- Anschließend Versandbehälter in die Styroporhülle verpacken und dem Fahrdienst mitgegeben. Der zugehörige Auftragsschein muss mit dem Kühlbehälter zusammen in einer Versandtüte eingeschickt werden, um Trennung von Material und Auftragsschein zu vermeiden.






- Der erste Morgenurin wird verworfen und die Zeit notiert.
- Ab diesem Zeitpunkt wird der Urin (auch bei Stuhlgang) gesammelt.
- Die letzte Sammlung erfolgt am nächsten Morgen zu der am Vortag notierten Zeit (Blase entleeren auch ohne Bedürfnis).
auf dem Anforderungsschein die ermittelte Sammelmenge!
| Parameter | 24h Sammelurin ohne Zusatz | 24h Sammelurin mit Salzsäure |
|---|---|---|
| 5-Hydroxy-Indolessigsäure | x | |
| Albumin | x | |
| Aldosteron | x | x |
| Alpha-1-Mikroglobulin | x | |
| Alpha-2-Makroglobulin | x | |
| Aminosäuren | x | |
| Calcium | x | |
| Carnitin | x | x |
| Chlorid | x | |
| Citrat | x | x |
| Cortisol frei | x | |
| Cystin | x | |
| Disk-Elektrophorese | x | |
| Eisen | x | x |
| Eiweiß und Elektrophorese | x | |
| Glucose | x | |
| Harnsäure | x | |
| Harnstoff | x | x |
| Histamin | x | |
| Homovanillinsäure | x | |
| Immunfixation | x | |
| Immunglobulin G | x | |
| Jodid | x | |
| Kalium | x | x |
| Katecholamine | x | |
| Kreatin | x | x |
| Kreatinin | x | x |
| Kupfer | x | x |
| Magnesium | x | |
| Melatoninsulfat | x | |
| Metanephrine | x | |
| Methylhistamin | x | |
| Natrium | x | x |
| Normetanephrine | x | |
| Oxalat | x | |
| Phosphat | x | x |
| Porphyriediagnostik | x | x |
| Serotonin | x | |
| Sulfat | x | |
| Tetrahydroaldosteron | x | x |
| Transferrin | x | |
| Vanillinmandelsäure | x | |
| Zink | x | x |
Senden Sie bitte keine ganzen Sammelgefäße ein,
sondern nur ein entsprechendes Aliquot mit Beschriftung der Sammelmenge!
Für Besonderheiten in der mikrobiologischen Diagnostik siehe Urin für mikrobiologische Untersuchungen.
Bei Verwendung mehrerer Sammelgefäße (z. B. aufgrund des Einsatzes von Diuretika) sollte ein Aliquot von der Gesamtmenge angefertigt werden. Hierbei bitte verhältnismäßige Anteile aus jedem Sammelgefäß vermischen (siehe Beispiel):
Das Volumen-Verhältnis bei zwei Sammelgefäßen muss unbedingt eingehalten werden.
Die Gesamtmenge des gesammelten Urins muss auf dem Schein vermerkt sein.


Liquorproben so schnell wie möglich ins Labor transportieren!



Speichelproben sind kein Sputum.
Informationen zur Sputumgewinnung siehe Mikrobiologische Untersuchungen - Sputum
- Art des Materials / Entnahmeort
- Datum und Zeitpunkt der Entnahme
- (Verdachts-)Diagnose
- Erkrankungsbeginn
- Antimikrobielle, antibiotische oder antimykotische Therapie
- Gewinnung möglichst mit Hilfspersonal
- Nach sorgfältiger Händewaschung die Vorhaut vollständig zurückziehen
- Glans penis mit Tupfer und reinem Wasser reinigen, dann mit zweitem Tupfer trocknen
- Etwa die Hälfte der Blasenfüllung in die Toilette ablassen, dann ohne Unterbrechung des Harnstrahls etwa 5 ml in Gefäß (breite Öffnung) auffangen.
- Verschluss aufsetzen, ohne den Gefäßrand zu berühren
- Gewinnung mit Untersuchungsstuhl, sonst Hilfspersonal
- Kleidung und Unterwäsche ausziehen, Hände waschen
- Auf Untersuchungsstuhl, sonst auf dem WC-Sitz und unter seitlichem Abwinkeln eines Oberschenkels mit einer Hand die Labien spreizen und geöffnet halten
- Mit anderer Hand Vulva mit angefeuchtetem Tupfer von vorn nach hinten reinigen, mit zwei weiteren Tupfern nacheinander in gleicher Weise nachreinigen, Orifiziumbereich mit viertem Tupfer trocknen
- Etwa die Hälfte des Urins in die Toilette ablassen und ohne Unterbrechung des Harnstrahls etwa 5 ml in bereitgestelltem, sterilem Einwegbecher auffangen, ohne dessen Rand oder Innenfläche durch Finger, Vulva, Oberschenkel etc. zu berühren.
- Urin in steriles Röhrchen umfüllen und verschließen.



Liquorproben so schnell wie möglich ins Labor transportieren!
- Vor der Expektoration Mund mehrmals mit frischem Trinkwasser spülen (nicht bei Verdacht auf Mykobakterien-Infektion). Gegebenenfalls Zahnprothesen entfernen.
- Deckel des Sputumbehälters entfernen. Das Auffanggefäß darf nur von außen angefasst werden.
- Tief ein- und ausatmen. Nach jedem Einatmen den Atem für 3-5 Sekunden anhalten. Diesen Vorgang möglichst mehrmals wiederholen. Durch die Atemarbeit wird die Lunge gut entfaltet und die Produktion von Sputum angeregt.
- Erneut tief Luft holen und Sputum abhusten.
- Sputumbehälter sofort beim Praxispersonal abgeben. Der rasche und gekühlte Transport ins Labor ist wichtig.
Sputum ist keine Speichelprobe.
Informationen zur Speichelprobengewinnung siehe Weiteres Untersuchungsmaterial
Nicht für PCR geeignet!

Medium bitte nicht entfernen, abkippen oder auffüllen!


- Vor Abnahme unbedingt zweimalige Desinfektion der Punktionsstelle mit sterilem Tupfer, zunächst mit Alkohol, dann am besten mit jodhaltigen Mitteln, um eine Verunreinigung durch Hautkeime zu vermeiden.
- Vermeiden Sie eine erneute Venenpalpation.
- Nach Entfernen der Kappe Gummistopfen desinfizieren.
- Die Blutentnahme sollte mit einem geschlossenen System (z. B. BD-Vacutainer® Sicherheits-Blutentnahme-Set) vorgenommen werden.
- Füllvolumina der Probenflaschen voll ausnutzen. Optimal sind 8 bis 10 ml. Das Maximum sollte nicht überschritten werden.
- Zuerst die aerobe Flasche beimpfen, um den Eintritt von Luft aus der Spritze in die anaerobe Flasche zu vermeiden. Dann die anaerobe Flasche beimpfen.
- Blutkulturflaschen mit Entnahmezeitpunkt und Datum beschriften.
- Blutkulturflaschen der Firma Becton-Dickinson für den Versand in PET-Flaschen verpacken.
- Proben schnellstmöglich abholen lassen.
- Die Lagerung beimpfter Flaschen ist bei Raumtemperatur bis zu 48h möglich.



Untersuchungsmaterial nicht in Abstrichröhrchen mit Gel oder in Gefäßen mit Formalin einsenden.


| Material | Volumen | Bemerkungen |
|---|---|---|
| Sputum | 2 - 5 ml | kein Sammelsputum über mehr als 1 h; Speichel nicht geeignet; ohne Zusatz; 3 Proben von verschiedenen Tagen |
| Bronchialsekret | 2 - 5 ml | ohne Zusatz |
| bronchoalveoläre Lavageflüssigkeit | 20 - 30 ml | ohne Zusatz |
| Magennüchternsekret | 2 - 5 ml | Phosphatpuffer zugeben; bitte im Labor Transportgefäß anfordern |
| Magenspülwasser | 20 - 30 ml | Phosphatpuffer zugeben; bitte im Labor Transportgefäß anfordern |
| Biopsien | repräsentative Menge | 1 ml physiologische NaCl-Lösung zugeben; kein Formalin |
| Punktate (Aszites- und Pleurapunktat) | 30 - 50 ml | ohne Zusatz |
| Liquor | mögl. große Menge 3 - 5 ml | je für Kultur und PCR |
| Urin | mindestens 30 ml | nach reduzierter Flüssigkeitsaufnahme während der Nacht der erste morgens entleerte Urin; ohne Zusatz; KEIN SAMMELURIN! 3 Proben von verschiedenen Tagen |
| Blut | 5 - 10 ml | spezielle Citratblutröhrchen im Labor anfordern; Untersuchung nur bei Patienten mit schweren Immundefekten sinnvoll |
| Knochenmark | möglichst große Menge | Zusatz von Citrat |
| Stuhl | 1 - 2 g | bei immunsupprimierten Patienten; bei V. a. Darm-TB sollten Darmbiopsien untersucht werden |
| Menstruationsblut | möglichst 2 ml, gynäkologisch gewonnen | im Verhältnis 1:1 mit sterilem Wasser versetzt |
| Sperma und Prostatasekret | möglichst große Menge | ohne Zusatz |
- Gewinnung des Probenmaterials mit Handschuhen
- Das für die Untersuchung geeignete Material (EDTA-Blut, Liquor, Urin, Punktate, Abstriche etc.) entnehmen Sie bitte dem Leistungsverzeichnis.
- Bei der Verwendung von Liquor müssen die ersten Tropfen verworfen bzw. für andere Untersuchungen verwendet werden. Liquor in sterilem Gefäß versenden.
- Bei der Verwendung von Urin sollte Erststrahlurin vom 1. Morgenurin in sterilen Röhrchen eingesandt werden (kein Mittelstrahlurin).
- Bei der Verwendung von Abstrichtupfern kommen je nach Parameter unterschiedliche Tupfer (trockene oder mit Flüssigmedien) zum Einsatz. Verwenden Sie niemals Abstrichtupfer mit Transportgelen.
| Molekulargenetik, Immungenetik, Pharmakogenetik | |
|---|---|
|
Mutationssuche, Polymorphismen, genetische Marker, HLA-Typisierung |
1 ml EDTA-Blut |
|
Triple-Repeat-Erkrankungen (z.B. Fragiles X-Syndrom) |
Optimal 3 ml EDTA-Blut, mindestens 1 ml EDTA-Blut (bei Kleinkindern und erschwerten Abnahmebedingungen) |
| Zytogenetik und Reproduktionsgenetik | |
|---|---|
| Pränataldiagnostik |
Fruchtwasser (15-20 ml) steril entnommen oder Chorionzotten (10-30 mg) |
| Chromosomenanalyse | 2-5 ml heparinisiertes Vollblut |
| Abortdiagnostik |
Plazenta- und fötales Gewebe (z.B. Nabelschnur, Haut) oder Fascia lata in steriler physiologischer NaCl-Lösung |
| Array-CGH |
1-2 ml EDTA-Blut oder mind. 3µg DNA, Mindestkonzentration 100ng/µl |
| Methylierungsdiagnostik | 1-2 ml EDTA-Blut |
| Polkörperdiagnostik 1) |
Polkörper auf Objektträger fixiert (FISH) oder in Spezialgefäßen (PCR) |
| Molekulare Onkologie | |
|---|---|
| Tumorzytogenetik |
mind. 5 ml heparinisiertes Knochenmark oder ggf. 5 ml heparinisiertes Vollblut |
| Molekulargenetik (z.B. BCR/ABL, JAK2) |
2 ml EDTA-Blut oder EDTA-Knochenmark |

| • Ersttrimesterscreening: | SSW 11+1 bis 13+6: PAPP-A, freies β-HCG |
| • Neuralrohrdefekt-Screening: | SSW 14+0 bis 17+6: AFP |
| Probenmaterial | Empfohlene Lagerbedingungen |
|---|---|
|
Serum alle Untersuchungen |
Kühlschrank (+2°C - +8°C) |
|
EDTA-Blut Blutbild |
Raumtemperatur |
|
EDTA-Blut PCR-Untersuchungen |
Kühlschrank (+2°C - +8°C) |
| Citrat-Blut | Raumtemperatur bis ca. 8 Stunden |
|
Citrat-Plasma Gerinnungsuntersuchungen |
Ggf. einfrieren. Siehe Leistungsverzeichnis (< -18°C) |
|
Abstriche, Sputum Mikrobiologie, Genetik |
Wenn möglich Kühlschrank (+2°C - +8°C), Raumtemperatur (<20°C) |
| NaF-Blut | Raumtemperatur |
|
Blutkulturen Nachweis von Erregern |
Wärme-/Brutschrank (ca. +36°C) (Bei Fehlen eines Brutschrankes Raumtemperatur) |
|
Liquor Mikrobiologische Untersuchung |
Wärme-/Brutschrank (ca. +36°C) Ggf. eine Blutkulturflasche beimpfen (bei Fehlen eines Brutschrankes Raumtemperatur) |
|
Liquor Immunologische Untersuchung |
Kühlschrank (+2°C - +8°C) |
|
Liquor Zellzahl- / Zellartbestimmung |
Sofortiger Transport ins Labor! |
|
Urinprobe Alle Untersuchungen |
Kühlschrank (+2°C - +8°C) |
- Materialkennung / Beschriftung der Probe
- Anlegen des Überweisungsscheins
- Verpackung der Probe für den Transport
- Vorbereitung des Transportes

- Arztnummer
- Name des Patienten (Vor-, Zuname)
- Geburtsdatum des Patienten
- Kontrollieren Sie beim Ausdruck, ob Ihr Drucker richtig justiert ist und die Scheine korrekt eingelegt sind
- Vermeiden Sie zusätzliche Beschriftungen auf dem Muster 10A-Schein
- Die Scheine dürfen nicht gestempelt werden
- Bitte knicken Sie die Scheine nicht
- Verwenden Sie zum Ausfüllen den Schrifttyp Courier bzw. Courier New 10 Punkt

- Betriebsstättennummer und lebenslange Arzt-Nr. (LANR) Ihrer Praxis hier eintragen
- Nur auszufüllen wenn Sie selber mit Muster 10 von einem anderen Arzt beauftragt wurden und einzelne Parameter weiterüberweisen!
- Bei eiligen Untersuchungen kann der Dringlichkeitsstatus durch ankreuzen markiert werden. Auch kann ein alternativer Befundweg per Telefon und / oder Fax angegeben werden.
- Im Feld „Diagnose / Verdachtsdiagnose“ muss ein Eintrag erfolgen. Die Diagnose / Verdachtsdiagnose kann in Klarschrift oder als ICD-10-Verschlüsselung erfolgen. Die Angabe mehrerer Diagnosen / Verdachtsdiagnosen ist möglich.
- Optional können im Feld „Befund / Medikation“ weitere Angaben zum Patienten bzw. dessen Erkrankung gemacht werden.
-
Leistungsart präventiv ist zu kennzeichnen für Leistungen nach der Gesundheitsuntersuchungs-, Kinder-, Mutterschafts-Richtlinien, der Krebsfrüherkennungsprogramme und der Richtlinie für organisierte Krebsfrüherkennungsprogramm des Gemeinsamen Bundesausschusses.
Zur Früherkennung des Zervixkarzinoms nach der Richtlinie für organisierte Krebsfrüherkennungsprogramme des Gemeinsamen Bundesausschusses bitte Muster 39 verwenden. - Wenn die Behandlung aufgrund oder als Folge eines Unfalls erforderlich wird
- Barcode-Etikett Arzt-/Patientennummer bitte hier einkleben
- Im Datumsfeld muss das Abnahmedatum der Probe eingetragen werden, nicht das Ausstellungsdatum des Ü-Scheins. Das Abnahmedatum wird in den Befund übernommen.
- Geschlecht des Patienten wird durch einen Buchstaben angegeben. D = divers, M = männlich, W = weiblich, X = unbestimmt




- Im Gegensatz zu den meisten EDV-Systemen greift star.net®Labor immer auf das aktuelle Leistungsverzeichnis Ihres Labors zurück. Eventuelle Änderungen, z. B. bzgl. des benötigten Untersuchungsmaterials, sind sofort eingepflegt.
- Je nach Untersuchung informiert star.net®Labor Sie anhand einer optischen Darstellung über die benötigten Probengefäße. Auch zeigt star.net®Labor weiterführend umfangreiche Abnahme- und Transporthinweise auf.
- Der Etikettendruck mit Patientendaten für Anforderungsscheine und Probengefäße findet direkt in der Praxis statt. Dies gewährleistet eine sichere Identifizierung von Probe und Auftrag.
- Abschließend kontrolliert star.net®Labor, ob alle für die Anforderung nötigen Angaben gemacht wurden.
- Der Auftrag wird mit eindeutig definierten Analysenbezeichnungen direkt an das Labor versandt. Schreib-, Scan- und Verständnisfehler zwischen Labor und Praxis können so vermieden werden.
- Kostenlose Nutzung der Anwendung
- Kostenloser Support durch unsere Mitarbeiter
- Höchste Datensicherheit durch SSL-Verschlüsselung
- Übersichtliche Darstellung ausgewählter Analysen
- Problemloses Erstellen von Wiederholungsaufträgen
- Weniger Abstimmungsbedarf zwischen Praxis und Labor
- Schnellere Befundzustellung
- Zeit- und standortunabhängiger Abruf von Befunden
- Speichern und Drucken von ansprechenden und übersichtlichen Befunden zur Weitergabe an Ihre Patienten
- Alle Analysen des Labors auf Knopfdruck ordern
- Individuell gestaltbare Favoriten
- Unkompliziertes Nachfordern von Analysen
- Steuerung der Abrechnungsart von Laborleistungen
- Belegloses Anfordern im LG-Bereich
- Belegloses Anfordern im Speziallaborbereich unter bestimmten praxisseitigen Voraussetzungen (z. B. eHBA - elektronischer Arztausweis zur Signatur)

- Verpacken Sie Materialien mit eiligen Anforderungen in die „Rote Tüte“, damit wir die Proben im Labor sofort identifizieren und an den Arbeitsplatz weiterleiten können.
-
 Kennzeichnen Sie Material und Überweisungsschein mit dem Aufkleber „Eilige Untersuchung“, damit eine schnelle Erfassung gewährleistet wird.
Kennzeichnen Sie Material und Überweisungsschein mit dem Aufkleber „Eilige Untersuchung“, damit eine schnelle Erfassung gewährleistet wird. - Bedenken Sie: für jeden Sonderfall müssen Routineabläufe unterbrochen und Proben anderer Patienten zurückgestellt werden. Beschränken Sie Sonderfälle auf wirklich dringliche Fragestellungen!
- Bitte vergessen Sie nicht: manchmal zeigt ein Laborwert eine lebensbedrohliche Erkrankung eines Patienten an. In diesen Fällen unternehmen wir alles, um Ihnen einen Notfallwert auch außerhalb der Praxisöffnungszeiten mitzuteilen. Hierzu benötigen wir eine Kontaktmöglichkeit (Privat-Nr., ggf. Tel.-Nr. des diensthabenden Arztes oder Praxisvertreters)
- Handgeschrieben schlecht lesbar oder Druckerschrift sehr klein (am Besten – Courier 10 Punkt - verwenden)
- Druckerfarbbänder farblos
- Angaben zum Patienten werden zeilenversetzt oder bei Privatscheinen ins schraffierte Feld gedruckt, Ü-Scheine falsch eingelegt, Drucker- oder EDV-Justierung falsch eingestellt
- Datum entspricht nicht Abnahmedatum
- Diagnose / Verdachtsdiagnose fehlt
- Keine Unterscheidung Diagnose / Anforderung
- Art der Untersuchung nicht oder nicht eindeutig angegeben
- Verwendung von Überbegriffen (z. B. Rheumaserologie, Spurenelemente, Schwermetalle, Hormonstatus)
- Verwendung ungebräuchlicher Abkürzungen oder Synonyme
- Leistungsanforderung nicht EBM-fähig (z. B. CDT auf Kassenschein)
- Urinsammelmengen fehlen bei Sammelurin
- Entnahmeort des Materials fehlt bei mikrobiologischen Proben oder Punktaten
- Nur ein Material eingesendet, obwohl für die Laborgemeinschaft und für das Speziallabor Untersuchungen angefordert werden
- Falsches Material, falsch gekennzeichnetes Material
- Auf dem Ü-Schein fehlt der Hinweis auf eine parallel eingesandte LG-Probe mit der entsprechenden Karten-Nummer
- Auf Röhrchen fehlt Patientenname, Arzt-Patientennummer oder Arztnummer
- Aufkleber für Material fehlen (z. B. PCR, Punktat, Plasma)
- Urinbehälter nicht fest verschlossen
- Haltbarkeit des Probengefäßes abgelaufen (z. B. Blutkulturflaschen, Urikult ausgetrocknet)
- Falsche Probenentnahme (z. B. Urikult nicht in Urin eingetaucht, sondern mit Tupfer beimpft)
- Probengefäß überfüllt (z. B. Stuhlbehälter mehr als ein Drittel überfüllt)
- EndToEnd-Kapillare (Kapilette) nicht luftblasenfrei gefüllt, nicht vollständig mit Blut gefüllt, Blut nicht ausgespült, falsche Kapillare, evtl. außen an Kapillare anhaftender Blutstropfen nicht entfernt
- Sortierung der Proben im Transportkarton nicht beachtet
- Verwendung des falschen Probengefäßes (z. B. Stuhl im Gurkenglas)
- Fehlende Transportverpackung (z. B. Stuhlröhrchen oder Sporenstreifen ohne Umverpackung)
- Falsche Lagerung der Probe bis zum Transport (z. B. Gefrierproben)
- bei Nachsendung einer Probe wird nur ein Ü-Schein verwendet, der auch für die bereits eingetroffene Probe gilt (Bsp.: gefrorene Proben nachgesendet, Anforderung auf Schein vom Vortag)
siehe Hinweis unter Verpackung der Proben für den Transport
- Hinweis fehlt, dass der Ü-Schein nur zur Abrechnung nachgeschickt wurde

